- 접종일 계산기
- 무료 접종 대상 확인
걱정하지 마세요!
로타텍®의 첫 효과*는 1차 접종 14일 후부터 시작됩니다.1,a,§
또한 로타텍®은 1차 접종 후 14일부터 만 7세까지 효과†가 지속될 수 있습니다.2,b,¶


※ 건강한 영아 7만여명을 대상으로 시행한 대규모 위약 대조 임상 REST 후속 연구 결과1
※ 미국 질병관리본부(CDC)에서 로타바이러스 백신의 장기간 유효성을 평가하기 위해 시행한 연구 결과2
※ 로타텍®은 3회에 걸쳐 투여해야 합니다.
다시 먹는 것은 권장하지 않습니다.
아기가 백신을 토하거나 뱉어내 투여량이 권장량에 못 미치더라도 추가 투여하지 않고
다음 접종 스케줄에 맞추어 백신을 접종하면 됩니다.
1차는 생후 6주부터 14주 6일까지, 접종은 최소 4주 간격이 되어야 합니다.
3차는 최대 8개월까지 접종이 필요합니다.
정확한 일정은 질병관리청 및 대한 소아과학회 예방접종지침서에서 권고하는 아래의 일정을 꼭 참고해주세요.3,4

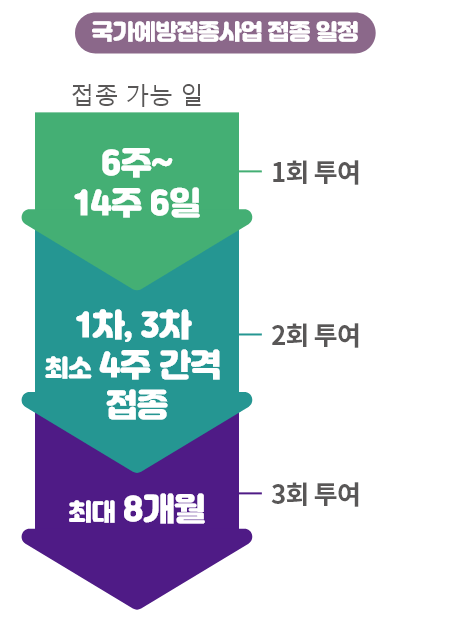 ※ 생후 6주 0일부터 14주 6일 이내에 1차 접종하고, 최소 4주 간격으로 추가 접종합니다. 3차 접종은 생후 32주(생후 8개월 0일)를 넘어서는 안 됩니다.3,4
※ 생후 6주 0일부터 14주 6일 이내에 1차 접종하고, 최소 4주 간격으로 추가 접종합니다. 3차 접종은 생후 32주(생후 8개월 0일)를 넘어서는 안 됩니다.3,4
* G1-G4 RV 급성 위장관염으로 인한 입원 및 응급실 방문 예방 효과1 † 다음의 공식을 사용하여 RV 관련 입원 및 응급실 방문 시 RV 백신의 예방 효과를 추정하였습니다 : VE = (1-odds ratio) x 100.2 § [Study result] 로타텍 1차 접종 14일 이후 G1-G4 RV 급성위장관염으로 인한 입원 및 응급실 방문 건수는 0건이었습니다. (n=0/29,417; 95% CI, 72-100%).1 ¶ [Study result] 로타바이러스 2개 시즌에 걸쳐, 5가 백신 3회 접종 완료 시 백신 효과는 80% (95% CI, 74%–84%), 1가 백신 2회 접종 완료 시 백신 효과는 80% (95% CI, 68%–88%)였습니다. 통계적으로 유의한 백신 유효성은 충분한 데이터로 분석이 가능했던 각 연도에서 관찰되었습니다.(5가 백신은 7년, 1가 백신은 3년).2 ※ 로타텍은 영아에서 G1, G2, G3, G4, G9P1A[8] 혈청형 로타바이러스에 의한 위장관염 예방에 적응증이 있습니다. 이 백신은 모든 투여자에서 완전한 예방 효과를 보이지 않을 수도 있으며, 1차 투여는 생후 6~12주에 하고, 이후 각 투여 간 4주 내지 10주의 간격을 두고 추가 투여합니다. 3차 투여는 생후 32주를 넘어서는 안 되며, 1회 또는 2회의 투여가 어느 정도의 예방 효과를 가져오는지에 대한 연구는 이루어진 바 없습니다. Study design a. 본 로타바이러스의 효능 및 안전성을 평가한 사후 분석 연구(REST)에서는 5가 로타바이러스 백신이 3회분 접종을 완료하기 전에 로타바이러스 위장관염(RVGE)에 대한 조기 예방이 가능한지의 여부를 확인해보고자 하였습니다. 5가 로타바이러스 백신 또는 placebo 3회 모두 접종한 유아에서 RVGE 관련 입원 및 응급실(ED) 방문 비율을 낮추는 5가 로타바이러스 백신 투여 횟수 별 유효성을 평가하기 위해, 각각 1회차 밎 2회차 투여후 2주부터 후속 투여 시까지 발생하는 사건(분석 A)과 1회 차 및 2회 차 투여 후 2주부터 후속 투여 후 2주까지 발생하는 사건(분석 B)을 분석하였습니다. 1회차~2회차 사이에 58,851명의 피험자(백신 투여군, n=29,417; 위약 투여군, n=29,434)가 포함되었고, 2회차~3회차 사이에 59,061명의 피험자(백신 투여군, n=29,496; 위약 투여군, n=29,565)가 포함되었습니다.1 b. 본 다기관, 능동 감시 연구는 다양한 인구통계학적 및 세속적인 측면에서 급성 위장관염으로 인한 입원 및 응급실 방문 예방에 대한 1가 및 5가 로타바이러스 백신 유효성을 평가하기 위해 수행되었습니다. 로타바이러스 2개 시즌(2012년, 2013년) 동안 7개의 의료기관에서 급성 위장관염으로 입원하거나 응급실에 내원한 소아를 대상으로 하였습니다. 대변 검체에서 효소 면역분석법을 이용하여 로타바이러스 검사 및 유전자형을 분석하였고, 로타바이러스 양성인 경우와 로타바이러스 음성인 급성 위장관염 대조군에 대해 로타바이러스 백신 접종 이력을 비교하였습니다. 백신 유효성은 백신 접종 횟수, 계절, 임상 환경, 연령, 우세한 유전자형 및 인종별로 계층화하여 각 백신 별 로타바이러스 관련 입원 및 응급실 방문 예방으로 계산하였습니다.2 References 1. Dennehy PH, et al. Efficacy of the pentavalent rotavirus vaccine, RotaTeq® (RV5), between doses of a 3-dose series and with less than 3 doses (incomplete regimen). Hum Vaccin. 2011;7(5):563–568. Payne DC, et al. Long-term consistency in rotavirus vaccine protection: RV5 and RV1 vaccine effectiveness in US children, 2012-2013. Clin Infect Dis. 2015;61(12):1792-9. 3. 질병관리청. 2023년도 로타바이러스 국가예방접종 지원사업 관리지침. 2023. 4. 대한소아과학회. 예방접종지침서. 제9판. 2018.
로타텍®주요 안전성 정보 (Selected safety information) [효능·효과] 영아에서 G1, G2, G3, G4, G9P1A[8] 혈청형 로타바이러스에 의한 위장관염 예방 [용법·용량] 1. 경구 투여용으로만 사용하고 주사용으로 사용하지 말 것. 이 백신은 매 회차에 1튜브(2 ml) 전량을 경구 투여하고, 3차에 걸쳐 투여한다. 1차 투여는 생후 6~12주에 하고, 이후 각 투여 간 4주 내지 10주의 간격을 두고 추가 투여한다. 3차 투여는 생후 32주를 넘어서는 안 된다. 이 백신 투여 전후에 영아의 음식 또는 음료(모유포함) 섭취에 있어 특별한 제한은 없다. 2. 백신 투여방법. 이 백신은 바로 경구 투여할 수 있도록 비틀어서 여는 뚜껑의 플라스틱 튜브(라텍스 성분이 없는)에 개별 포장되어 있다. 백신이 담긴 튜브는 파우치 포장에 싸여있다. [일반적 주의] 면역결핍 가능성이 있는 영아들에 대한 이 백신의 안전성 또는 유효성과 관련된 임상시험 결과는 없다; 1) 혈액질환, 백혈병, 모든 종류의 림프종 또는 골수나 림프계에 영향을 미치는 악성종양이 있는 영아. 2) 면역억제치료(고용량의 전신 코르티코스테로이드 투여 포함)를 받고 있는 영아. 국소 코르티코스테로이드나 흡입 스테로이드 제제로 치료를 받고 있는 영아에게는 이 백신을 투여할 수 있다. 3) HIV/AIDS 환자 또는 HIV에 감염 소견이 관찰되는 등 원발성 혹은 후천성 면역결핍 상태에 있는 영아, 세포성 면역 결핍증, 저감마글로불린혈증 및 이상감마글로불린혈증인 영아. HIV/AIDS 산모에게서 태어나 HIV 상태가 불확정된 영아에게 이 백신이 투여 가능한지를 뒷받침하는 충분한 임상시험 자료는 없다. [사용상의 주의사항] 1. 다음 영아에는 투여하지 말 것. 1) 이 백신의 성분에 대해 과민반응의 기왕력이 있는 영아. 2) 이 백신 투여 후 과민반응이 의심되는 영아에게는 추가적인 투여를 실시해서는 안 된다. 3) 선천성 복부질환, 복부수술, 장중첩증의 병력을 가진 영아. 4) 급성 위장관 질환, 만성 설사로 성장지연이 있는 영아. 5) 면역 결핍이 있거나 의심되는 영아. 6) 중증혼합면역결핍증(SCID)이 있는 영아. 시판 후 중증혼합면역결핍증 영아에게 백신바이러스 관련 위장관염이 보고되었다. [약물이상반응] 1) 빈번히 보고된 이상반응 : 체온 상승, 구토, 설사, 보챔(irritability). 2) 매 투여 후 42일 이내에 백신군에서 통계적으로 유의하게 위약군보다 높게 나타난 이상반응 : 설사, 구토, 중이염, 비인두염, 기관지경련 [약물상호작용] 1. 방사선 치료, 항대사체, 알킬화제, 세포독성약물 및 코르티코스테로이드제(생리적 용량보다 고농도로 사용 시)와 같은 면역억제치료는 백신에 대한 면역반응을 감약할 수 있다. 2. 이 백신은 디프테리아-파상풍 톡소이드 및 백일해 백신(DTaP), 불활화 혹은 경구용 소아마비 백신(IPV 혹은 OPV), 헤모필루스 인플루엔자 b형 접합백신(Hib), B형 간염백신, 폐렴구균 접합백신, 뇌수막구균 백신, 6가 백신들과 함께 접종할 수 있다. 경구용 소아마비 백신과 이 백신의 병용 투여로 인해 소아마비 항원에 대한 면역반응이 달라지지 않는다. 경구용 소아마비 백신과의 병용으로 인해 로타바이러스 백신에 대한 면역반응이 다소 감소된다고 해도, 로타바이러스 중증 위장관염에 대해 예방 효력이 높은 수준으로 유지된다는 근거가 있다. 이 백신 투여 2주 후에 경구용 소아마비 백신을 투여할 경우, 이 백신의 면역반응은 영향받지 않는다. [영유아에 대한 투여] 생후 6주 미만의 영아 및 생후 32주 초과의 영아에 대한 이 백신의 안전성 및 유효성은 확립되지 않았다. 조산아에게 태어난 날로부터의 주수에 따라 이 백신을 투여할 수 있는 근거 자료가 있다. 조절이 가능한 위식도역류병(GERD: Gastroesophageal Reflux Disease)이 있는 영아에게 이 백신을 사용할 수 있음을 뒷받침하는 임상시험 자료가 있다. [임부 및 수유부에 대한 투여] 이 백신은 소아용 백신이며 성인에서의 용법은 없다. 개정년월일 : 2021년 5월 6일 ※ 다른 백신과 마찬가지로, 로타텍이 모든 투여자에서 완전한 예방 효과를 보이지 않을 수도 있습니다. ※ 보다 자세한 정보는 의료전문인과 상의해주시기 바랍니다.
부작용이 있을 수 있으니 「사용상의 주의사항」을 잘 읽고 의사, 약사와 상의하십시오. 인터넷 의약품 판매행위는 불법입니다. 아래 링크를 연결하실 경우 MSD의 사이트가 아닌 외부 사이트로 이동합니다. MSD는 해당 사이트에서 제공하는 컨텐츠에 대해 책임 지지 않습니다. 이동을 원하실 경우 링크를 클릭해주시기 바랍니다. [제품설명서전문확인하기]
광고심의필 : 2023-1668-105900
광고심의필 : 2023-1679-101901
로타텍® 주요 안전성 정보 (Selected safety information) [효능·효과] 영아에서 G1, G2, G3, G4, G9P1A[8] 혈청형 로타바이러스에 의한 위장관염 예방 [용법·용량] 1. 경구 투여용으로만 사용하고 주사용으로 사용하지 말 것. 이 백신은 매 회차에 1튜브(2 ml) 전량을 경구 투여하고, 3차에 걸쳐 투여한다. 1차 투여는 생후 6~12주에 하고, 이후 각 투여 간 4주 내지 10주의 간격을 두고 추가 투여한다. 3차 투여는 생후 32주를 넘어서는 안 된다. 이 백신 투여 전후에 영아의 음식 또는 음료(모유포함) 섭취에 있어 특별한 제한은 없다. 2. 백신 투여방법. 이 백신은 바로 경구 투여 할 수 있도록 비틀어서 여는 뚜껑의 플라스틱 튜브(라텍스 성분이 없는)에 개별 포장 되어 있다. 백신이 담긴 튜브는 파우치 포장에 싸여있다. [일반적 주의] 면역결핍 가능성이 있는 영아들에 대한 이 백신의 안전성 또는 유효성과 관련된 임상시험 결과는 없다; 1) 혈액질환, 백혈병, 모든 종류의 림프종 또는 골수나 림프계에 영향을 미치는 악성종양이 있는 영아. 2) 면역억제치료(고용량의 전신 코르티코스테로이드 투여 포함)를 받고 있는 영아. 국소 코르티코스테로이드나 흡입 스테로이드 제제로 치료를 받고 있는 영아에게는 이 백신을 투여할 수 있다. 3) HIV/AIDS 환자 또는 HIV에 감염 소견이 관찰되는 등 원발성 혹은 후천성 면역결핍 상태에 있는 영아, 세포성 면역 결핍증, 저감마글로불린혈증 및 이상감마글로불린혈증인 영아. HIV/AIDS 산모에게서 태어나 HIV 상태가 불확정된 영아에게 이 백신이 투여가능한지를 뒷받침하는 충분한 임상시험 자료는 없다. [사용상의 주의사항] 1. 다음 영아에는 투여하지 말 것. 1) 이 백신의 성분에 대해 과민반응의 기왕력이 있는 영아. 2) 이 백신 투여 후 과민반응이 의심되는 영아에게는 추가적인 투여를 실시해서는 안 된다. 3) 선천성 복부질환, 복부수술, 장중첩증의 병력을 가진 영아. 4) 급성 위장관 질환, 만성 설사로 성장지연이 있는 영아. 5) 면역 결핍이 있거나 의심되는 영아. 6) 중증혼합면역결핍증(SCID)이 있는 영아. 시판 후 중증혼합면역결핍증 영아에게 백신바이러스 관련 위장관염이 보고되었다. [약물이상반응] 1) 빈번히 보고된 이상반응 : 체온 상승, 구토, 설사, 보챔(irritability). 2) 매 투여 후 42일 이내에 백신군에서 통계적으로 유의하게 위약군보다 높게 나타난 이상반응 : 설사, 구토, 중이염, 비인두염, 기관지경련 [약물상호작용] 1. 방사선 치료, 항대사체, 알킬화제, 세포독성약물 및 코르티코스테로이드제(생리적 용량보다 고농도로 사용 시)와 같은 면역억제치료는 백신에 대한 면역반응을 감약할 수 있다. 2. 이 백신은 디프테리아-파상풍 톡소이드 및 백일해 백신(DTaP), 불활화 혹은 경구용 소아마비 백신(IPV 혹은 OPV), 헤모필루스 인플루엔자 b형 접합백신(Hib), B형 간염백신, 폐렴구균 접합백신, 뇌수막구균 백신, 6가 백신들과 함께 접종할 수 있다. 경구용 소아마비 백신과 이 백신의 병용 투여로 인해 소아마비 항원에 대한 면역반응이 달라지지 않는다. 경구용 소아마비 백신과의 병용으로 인해 로타바이러스 백신에 대한 면역반응이 다소 감소된다고 해도, 로타바이러스 중증 위장관염에 대해 예방 효력이 높은 수준으로 유지된다는 근거가 있다. 이 백신 투여 2주 후에 경구용 소아마비 백신을 투여할 경우, 이 백신의 면역반응은 영향 받지 않는다. [영유아에 대한 투여] 생후 6주 미만의 영아 및 생후 32주 초과의 영아에 대한 이 백신의 안전성 및 유효성은 확립되지 않았다. 조산아에게 태어난 날로부터의 주수에 따라 이 백신을 투여할 수 있는 근거 자료가 있다. 조절이 가능한 위식도역류병(GERD: Gastroesophageal Reflux Disease)이 있는 영아에게 이 백신을 사용할 수 있음을 뒷받침하는 임상시험 자료가 있다. [임부 및 수유부에 대한 투여] 이 백신은 소아용 백신이며 성인에서의 용법은 없다. 개정년월일 : 2021년 5월 6일
※ 다른 백신과 마찬가지로, 로타텍이 모든 투여자에서 완전한 예방 효과를 보이지 않을 수도 있습니다.
※ 보다 자세한 정보는 의료전문인과 상의해주시기 바랍니다.
※ 부작용이 있을 수 있으니 「사용상의 주의사항」을 잘 읽고 의사, 약사와 상의하십시오.
인터넷 의약품 판매행위는 불법입니다.
광고심의필 2023-1678-105100











